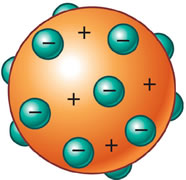
Cada substância no universo, rochas, mar, ser humano, os planetas e até mesmo as mais distantes estrelas são inteiramente feitos de partículas minúsculas chamadas átomos, que são pequenos demais para serem fotografados.
Essas pequenas partículas são estudadas na Química (ciência que cresceu na meia-idade) e na Física.
Para entender a complexidade desses átomos, diversos cientistas, como Rutherford, Dalton, Bohr e Thomson, articularam várias teorias. No século XIX, as diferentes leis de combinação e a tabela periódica dos elementos, criada em 1871, reforçaram o estudo da constituição dos átomos.
Após séculos de estudos sobre a interpretação da composição, propriedades, estruturas e transformações destas minúsculas partículas, chegou ao modelo que conhecemos hoje.